近日,美的医疗旗下的万东医疗超导磁共振成像系统获得由欧盟公告机构—德国莱茵TÜV集团签发的CE证书,使万东医疗成为中国第一个获得欧盟新医疗法规下的超导磁共振MDR证书,标志着拿到了进军欧洲市场的通行证。

CE认证作为产品进入欧洲市场的“签证”,是欧盟市场对于产品准入的强制性要求。医疗器械 (MDR)法规(EU)2017/745于2017年5月发布,自2021年5月26日正式取代欧盟原医疗器械指令(MDD,93/42/EEC)。欧盟MDR新规,参考了国际上成熟的医疗器械法规,特别是美国FDA对医疗器械的审批要求,建立了更现代化、更严格的法律框架。
相较于MDD指令,MDR法规对医疗器械的要求更加严格和全面,上市前认证评审难度更大,获证周期更长。这一新规提高了医疗器械的透明度和可追溯性,加强了警戒和市场监管,强化了制造商、NB、代理商等相关企业的责任。
不难看出,欧盟MDR新规强制执行后,对产品安全性和有效性要求更高,对企业的质量管理体系要求更完善,高门槛代表高含金量,但也势必会大大提高企业进行CE认证的难度,让国内许多中小型医疗器械企业将面临重大挑战。
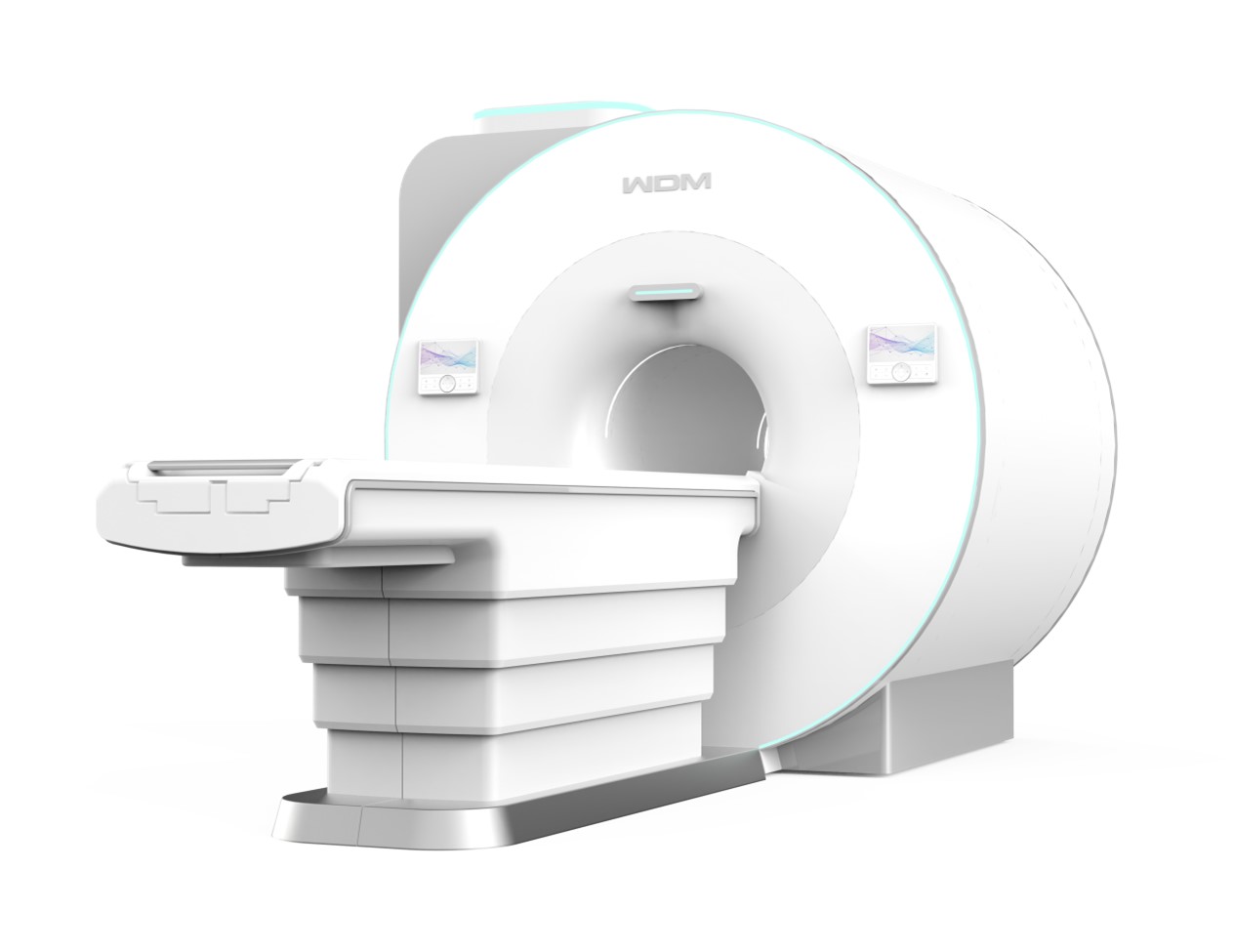
此次,万东医疗斩获国内首张超导MDR证书,表明中国企业的专业度和质量管理体系更加完善,国产超导磁共振的图像质量、稳定性、可靠性获得国际认可,具备了走向更广泛国际化的能力,为以万东医疗为代表的中国影像企业进一步开拓欧洲市场、服务全球用户建立良好开端。
备受全球瞩目的无液氦超导磁共振是万东医疗超导产品线的战略型产品,等于拿到了进军欧洲市场的通行证,未来让更多被氦资源“卡脖子”的国家也能实现超导磁共振使用自由。

 IOL观察
IOL观察
 数据
数据 报告
报告
 冷暖智造
冷暖智造
 EN
EN



